Resolución de exercicios tipo - Equilibrio Químico 3
Se introducimos 1 mol de H2(g) e 1 mol de I2(g) nun recipiente de 1 litro e, pasado certo tempo, atinxen a condición de equilibrio a 500 ºC, calcula a concentración de H2, I2 e HI no equilibrio.
Dato: Kc = 49.
Sabemos os moles iniciais dos reactivos e tamén o valor de Kc. Pídennos calcular as concentracións no equilibrio.
Paso 1: Montamos a táboa cos datos coñecidos
Temos:
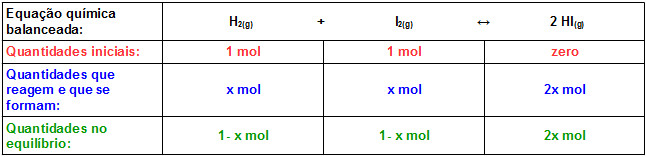
Paso 2: Calculamos concentracións no equilibrio a partir da expresión de Kc
Considerando que o volume é de 1 L e que Kc = 49, imos usar a expresión da constante de equilibrio Kc para descubrir as concentracións no equillibrio:
Kc = [HI]2
[H2] . [I2]
49 = (2x)2
(1-x) . (1-x)
49 = 4x2
1 – 2x + x2
45x2 – 98x + 49 = 0
Visto que temos unha ecuación de 2º grao aquí, teremos que usar a fórmula de Bhaskara para resolver:
-Fórmula xeral das ecuacións de 2º grao: ax2 + bx + c = 0;
- Fórmula de Bhaskara:
x = -b ± √b2 – 4 . a . c
2 . a
x = -(-98) ± √(-98)2 – 4 . 45 . 49
2 . 45
x = 98 ± √784
2 . 45
x = 98 ± √784
90
x1 = +1,4 > 1,0 mol (OLLO! Non ten significado físico porque sería maior do que as cantidades iniciais)
x2 = 0,78
Agora calculamos as concentracións no equilibrio:
[HI] = 2 x = 2 . 0,78 = 1,56 mol/L
[H2] = [I2] = 1 - x = 1 - 0,78 = 0,22 mol/L