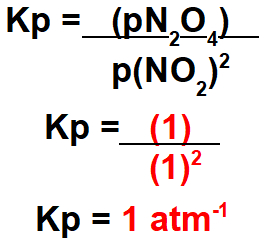Resolución de exercicios tipo - Equilibrio Químico 2
Observa a ecuación deste equilibrio:
Cando o equilbrio expresado enriba é alcanzado, a presión é 2 atm e hai 50% de NO2 en volume. Calcula o valor da constante de equilibrio das presións parciais, Kp.
O exercicio indica que a presión total do sistema no equilibrio é de 2 atm e que hai 50% de NO2, polo que podemos saber a fracción molar do NO2, que será 0,5. Logo, inicialmente, debemos determinar a presión parcial para cada gas no equilibrio por medio da Lei de Dalton das presións parciais, Pi = Xi . Pt:
-
Para o NO2:
pNO2 = 0,5 . 2
pNO2 = 1 atm
-
Para o N2O4: como no sistema existen apenas dous gases, a porcentaxe do N2O4 tamén será de 50%, para resultar um total de 100%, polo que a súa fracción molar tamén será 0,5.
pN2O4 = 0,5 . 2
pN2O4 = 1 atm
A constante de equilibrio, em termos de presións parciais, é calculada dividindo o resultado da multiplicación das presións parciais dos produtos gasosos polo produto das presións dos reactivos gasosos. No caso, a expresión do Kp será:
Lembrade que nós non imos pór unidades en Kp e Kc.
FEITO POLO DEPARTAMENTO DE FÍSICA E QUÍMICA DO IES CASTRO ALOBRE A PARTIR DE:
DIAS, Diogo Lopes. "Exercícios resolvidos sobre equilíbrios químicos"; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/quimica/equilibrio-quimico.htm. Acesso em 01 de fevereiro de 2021.