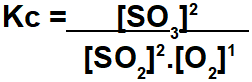Resolución de exercicios tipo - Equilibrio Químico 1
Un equilibrio envolto na formación da chuva ácida está representado pola ecuación:
Nun recipiente dun litro, foron mesturados 6 moles de dióxido de xofre e 5 moles de oxíxeno a 23ºC. Despois dalgún tempo, o sistema atinxiu o equilibrio, e o número de moles de trióxido de xofre medido nese momento foi 4. Determina o valor de Kc e Kp a esa T.
O exercicio pide calcular a constante de equilibrio en termos de concentración mol/L, Kc, e a constante en termos de presións parciais, Kp.
Paso 1: Que constante calculo primeiro?
Temos que ver os datos que nos dá o problema e decidir que nos é máis doado calcular con eles. Neste caso, podemos ver que temos os moles iniciais e o volume -polo que podemos calcular as concentracións en mol/L e Kc- e non temos as presións parciais, polo que parece máis complicado tentarmos calcular Kp. (Aínda que tamén se poderían calcular as presións parciais e despois Kp. Téntao!)
Para calcularmos Kc, debemos coñecer os valores das concentracións no equilibrio de cada participante da reacción. Lembra que a expresión do Kc para esta reacción sería:
Debemos ter moito cuidado para determinar os valores de cada participante no equilibrio, pois non sempre o exercicio fornecerá eses datos, como é o caso deste exemplo. Así, debemos seguir estes pasos:
Paso 2: Montar unha táboa cos valores coñecidos.
A chave para resolver estes exercicios está en montar unha táboa cos datos que nos dá o problema, tendo en conta ademais que a variación -neste caso, de moles- sempre vai ser proporcional aos coeficientes estequiométricos de cada componente do equilibrio.
Que significa isto? Ímolo ver co exemplo que temos. Os valores que nos dá o enunciado son os seguintes:
|
|
2 SO2 |
+ O2 ↔ |
2 SO3 |
| MOLES INICIAIS | 6 moles | 5 moles | |
| VARIACIÓN | |||
| MOLES NO EQUILIBRIO | 4 moles | ||
| CONCENTRACIÓN NO EQUILIBRIO |
Agora tempos que pensar un pouquiño. Inicialmente temos SO2 e O2, e non temos SO3. Despois, no equilibrio, vemos que hai 4 moles de SO3. Polo tanto, a reacción transcorre cara á dereita. Vaise formando SO3 a partir dos moles de SO2 e O2 iniciais. E como vai ser a variación? Pois proporcional aos coeficientes. Negativos para SO2 e O2 e positivo para o SO3 porque a reacción vai cara á dereita. E con eses números multiplicando a x (2 para o SO2, 1 para o O2 e 2 para o SO3 porque son os respectivos coeficientes estequiométricos).
|
|
2 SO2 |
+ O2 ↔ |
2 SO3 |
| MOLES INICIAIS | 6 moles | 5 moles | |
| VARIACIÓN | -2x | -x | 2x |
| MOLES NO EQUILIBRIO | 6-2x | 5-x | 2x |
| CONCENTRACIÓN NO EQUILIBRIO |
Paso 3: Determinar o valor do Kc.
Para determinar o valor do Kc, basta utilizarmos os valores encontrados no equilibrio nesta expresión:
Lembrade que nós non imos pór unidades en Kp e Kc.
FEITO POLO DEPARTAMENTO DE FÍSICA E QUÍMICA DO IES CASTRO ALOBRE A PARTIR DE:
DIAS, Diogo Lopes. "Exercícios resolvidos sobre equilíbrios químicos"; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/quimica/equilibrio-quimico.htm. Acesso em 01 de fevereiro de 2021.